Les lymphocytes T modifiés par récepteurs d’antigènes chimériques – connus sous le nom de T CAR – sont un nouvel outil puissant pour le traitement du cancer. La thérapie à base de cellules T-CAR (ou thérapie T-CAR) commence par l’extraction des cellules immunitaires du corps du patient. Ces cellules sont génétiquement modifiées pour reconnaître la propre tumeur du patient, puis sont réadministrées en grand nombre au patient. C’est ce qu’on appelle un type de transfert de cellules adoptives. Les cellules modifiées sont capables d’attaquer et de tuer spécifiquement les cellules cancéreuses. Cette thérapie suscite des réactions spectaculaires chez certains patients atteints de certains types de cancer avancé, notamment chez les enfants et les adultes atteints de cancers du sang comme la leucémie lymphoblastique aiguë (LLA) et les lymphomes.
Les lymphocytes T modifiés par récepteurs d’antigènes chimériques – connus sous le nom de T CAR – sont un nouvel outil puissant pour le traitement du cancer. La thérapie à base de cellules T-CAR (ou thérapie T-CAR) commence par l’extraction des cellules immunitaires du corps du patient. Ces cellules sont génétiquement modifiées pour reconnaître la propre tumeur du patient, puis sont réadministrées en grand nombre au patient. C’est ce qu’on appelle un type de transfert de cellules adoptives. Les cellules modifiées sont capables d’attaquer et de tuer spécifiquement les cellules cancéreuses. Cette thérapie suscite des réactions spectaculaires chez certains patients atteints de certains types de cancer avancé, notamment chez les enfants et les adultes atteints de cancers du sang comme la leucémie lymphoblastique aiguë (LLA) et les lymphomes.
En raison de l’infrastructure et de l’expertise considérables nécessaires pour administrer la thérapie T-CAR en toute sécurité et avec succès, il y avait eu très peu d’essais cliniques sur la thérapie T-CAR au Canada. BioCanRx a reconnu la nécessité de renforcer les infrastructures et la capacité de fabrication au Canada pour soutenir la recherche du laboratoire au chevet du patient et, ultimement, pour accroître l’accès à la thérapie T-CAR en augmentant le nombre d’essais cliniques offerts aux patients canadiens. Cette nouvelle capacité ouvrira également la voie aux innovations canadiennes dans le paysage des cellules T artificielles, qui ne peuvent actuellement pas dépasser le stade du développement en laboratoire.
« Les immunothérapies comme la thérapie T-CAR fonctionnent en renforçant le système immunitaire de l’organisme, pour l’aider à reconnaître et à tuer les cellules cancéreuses. Nous savons maintenant qu’en retirant des lymphocytes T des patients et en les modifiant, nous pouvons obtenir des réponses spectaculaires chez certains types de patients cancéreux. Malheureusement, au Canada, nous ne disposons pas de cette technologie qui pourrait être utilisée à grande échelle dans tout le pays. Les investissements de BioCanRx nous permettent donc de pouvoir fabriquer nous-mêmes ce type de produit, d’engager nos propres scientifiques pour qu’ils puissent réellement tester leurs idées, d’exploiter cette nouvelle technologie et, nous l’espérons, d’apporter quelque chose aux Canadiens beaucoup plus rapidement. » – Dr John Bell, directeur scientifique, BioCanRx
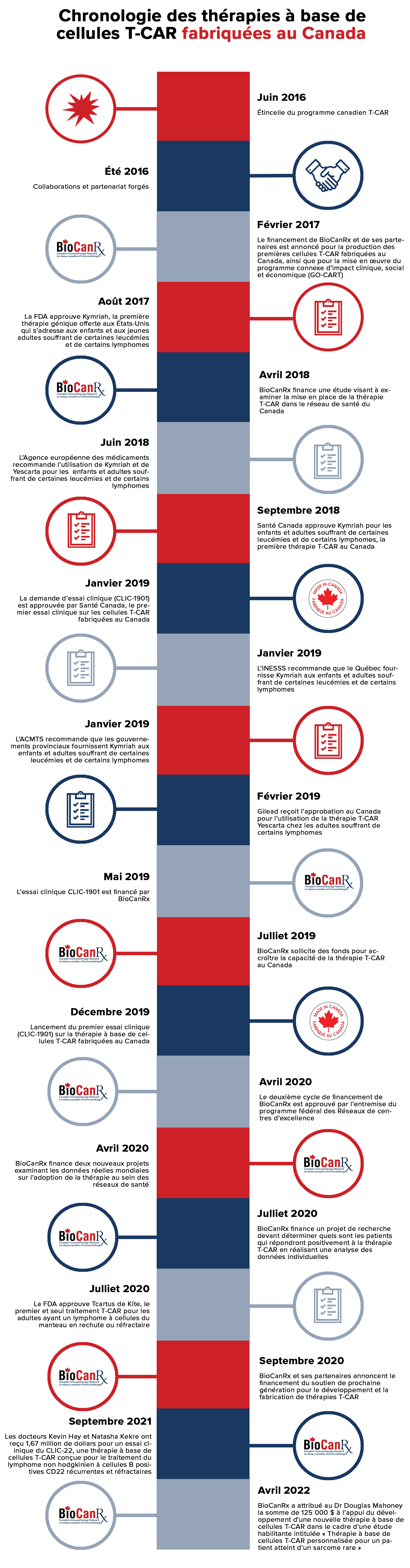
Chronologie de la thérapie à base de cellules T-CAR fabriquées au Canada
Juin 2016 : Étincelle du programme canadien T-CAR
Lors du Sommet sur l’immunothérapie du cancer, la conférence scientifique inaugurale de BioCanRx, un groupe de chercheurs du réseau BioCanRx a été inspiré par une séance sur les avancées en matière de thérapie et d’ingénierie des anticorps. Ils discutaient lors d’un événement social lorsque l’un d’entre eux a demandé : « Et si nous pouvions traiter les patients canadiens avec la thérapie T-CAR en renforçant nos capacités de fabrication clinique de cellules T-CAR au Canada? » Il s’agirait des premières cellules T-CAR fabriquées au Canada. Lors de cette première conversation, les docteurs John Bell (directeur scientifique de BioCanRx), Harry Atkins et Natasha Kekre (Hôpital d’Ottawa), ainsi que Robert Holt et Brad Nelson (Agence du cancer de la C.-B., ont échangé des idées de recherche. Leur idée a donné naissance à une nouvelle collaboration qui, à terme, devrait déboucher sur un programme de cellules T-CAR « fabriquées au Canada » afin de permettre aux patients canadiens d’avoir accès à cette thérapie ici même au Canada.
Été 2016 : Collaborations et partenariats forgés
Les chercheurs du réseau BioCanRx à Ottawa, Vancouver et Victoria ont commencé à préparer des propositions de projet pour obtenir des fonds, des partenaires et de l’expertise afin d’assurer une production sûre et efficace de thérapies T-CAR au Canada en utilisant une approche de fabrication au point de service. L’objectif était de fournir l’accès immédiat tout en soutenant la mise en place en clinique du développement des nouvelles cellules T-CAR. Chaque équipe de recherche disposait des ingrédients nécessaires pour soutenir une approche canadienne : fabrication de la structure à Vancouver (Rob Holt), fabrication du lentivirus comme vecteur viral à Ottawa et enfin, fabrication des cellules T-CAR à Victoria, et ce, afin d’assurer la fabrication du produit qui serait finalement administré aux patients. Comme les produits finaux doivent être administrés en clinique, ils doivent être fabriqués selon les bonnes pratiques de fabrication ou BPF, ce qui nécessite l’accès à des équipements et des installations hautement spécialisés qui font partie de l’écosystème de la biofabrication au Canada. BioCanRx a coordonné des réunions et des ateliers pour permettre aux scientifiques et aux cliniciens du Réseau de mettre au point les détails sur la façon de réunir toutes les différentes pièces du casse-tête, réalisant ainsi la synergie nécessaire à la fabrication de ce produit. Des demandes ont donc été présentées à BioCanRx dans le cadre de deux programmes en tandem et synergiques : le programme des projets dynamisants et le programme des projets d’impact clinique, social et économique.
Février 2017 : Le financement de BioCanRx et de ses partenaires est annoncé pour la production des premières cellules T-CAR fabriquées au Canada.
BioCanRx et ses partenaires ont annoncé un financement de près de 5 M$ pour la recherche visant à renforcer les capacités de fabrication de cellules T-CAR en clinique du Canada. Le Canada disposait de l’infrastructure essentielle mais un effort coordonné était requis de la part des chercheurs de plusieurs établissements et pour assurer l’intégration des capacités de fabrication des cellules T-CAR. Ce financement était nécessaire pour mettre en place et transférer pleinement l’expertise et les capacités requises pour mettre en œuvre cette nouvelle technologie. BioCanRx a investi dans des projets de recherche faisant progresser plusieurs modèles innovants de lymphocytes T artificiels, qui ont ensuite bénéficié de cet investissement dans les infrastructures et les capacités et qui ont accéléré la mise en œuvre de ces nouveaux modèles dans les essais cliniques au Canada. Les docteurs Rob Holt, John Bell, Natasha Kekre et John Webb ont dirigé le projet dynamisant sur le renforcement des capacités en matière de thérapies à base de cellules T-CAR au Canada.
Cette nouvelle a suscité de l’intérêt dans les médias suivants :
Ottawa poised to become manufacturing centre for cancer-fighting agent – The Ottawa Citizen, 16 février 2017
BC researchers Working to bring game changing cancer treatment to Canada – Global News, 14 mars 2017
Pour que la thérapie des cellules T-CAR soit apportée aux patients de manière sûre et efficace, BioCanRx a financé un projet complémentaire d’impact clinique, social et économique portant sur l’obtention de meilleurs résultats avec la thérapie à récepteurs d’antigènes chimériques (GO-CART) : un accélérateur de recherche de BioCanRx pour appliquer de manière sûre et efficace la thérapie des cellules T-CAR aux malignités hématologiques. Ce projet a passé en revue la base de connaissances existante et a assuré la contribution des patients dès le début du projet pour concevoir un protocole d’essai clinique T-CAR rigoureux, prêt à être mis en œuvre une fois que les produits seront prêts pour un essai clinique de phase 1. L’équipe de recherche a également examiné les facteurs économiques liés à la mise en œuvre de ce type de technologie dans le réseau de santé canadien. Ce projet était dirigé par les docteurs Manoj Lalu et Dean Fergusson, de l’Hôpital d’Ottawa, en collaboration avec la Société de leucémie et lymphome du Canada et deux patients partenaires : Terry Hawrysh et Stu Schwartz.
Le Dr Lalu décrit le projet GO-CART.
Cliquez ici pour lire l’étude publiée sur le projet GO-CART.
Août 2017 : La FDA approuve Kymriah (tisagenlecleucel), la première thérapie génique offerte aux États-Unis.
Kymriah a été approuvé pour certains patients pédiatriques et jeunes adultes atteints d’une forme de LLA. Pour en savoir plus, cliquez ici.
Avril 2018 : BioCanRx finance une étude visant à examiner différents modèles stratégiques de mise en oeuvre de la thérapie T-CAR dans le réseau de santé du Canada.
Dans le réseau de santé public canadien, le coût relativement élevé de la thérapie T-CAR pourrait empêcher des patients d’avoir accès à ce type de traitement. En collaboration avec l’ACMTS, l’organisme canadien d’évaluation des technologies de la santé, et financé en partie par BioCanRx, le Dr. William Wong (Université de Waterloo) a utilisé une approche novatrice pour établir une plateforme destinée à soutenir le processus de prise de décision concernant le remboursement et la mise en œuvre de la thérapie T-CAR. Par exemple, le Dr Wong a utilisé un modèle discret de simulation d’événements au niveau du réseau de santé pour examiner l’impact potentiel de l’augmentation des temps d’attente sur l’efficacité de la thérapie T-CAR et a montré que des retards modestes dans l’administration de la thérapie T-CAR entravent considérablement son efficacité. En effet, une augmentation d’un à neuf mois du temps d’attente pour l’accès à la thérapie T-CAR chez les patients atteints d’un lymphome diffus à grandes cellules B en rechute ou réfractaire a fait passer le taux de mortalité prévu sur un an de 36,1 % à 76,3 %. Les résultats de cette recherche fournissent une évaluation factuelle de cette thérapie et de sa place dans le réseau de santé, et ils servent de base aux chercheurs en essais cliniques et aux décideurs politiques pour améliorer les soins en oncologie.
Cliquez ici pour lire le rapport publié..
Juin 2018 : L’Agence européenne des médicaments recommande l’utilisation de Kymriah et de Yescarta.
Kymriah est recommandé pour le traitement des enfants et des jeunes adultes (jusqu’à 25 ans) atteints de LLA à cellules B en rechute ou réfractaires, et chez les patients adultes atteints de lymphome diffus à grandes cellules B en rechute ou réfractaire après deux cycles ou plus de thérapie systémique. Yescarta (Axicabtagene ciloleucel) est indiqué pour le traitement des patients adultes atteints d’un lymphome diffus à grandes cellules B en rechute ou réfractaire ou d’un lymphome médiastinal primaire à grandes cellules B, après deux cycles ou plus de traitement systémique. Pour en savoir plus, cliquez ici.
Septembre 2018 : Santé Canada approuve Kymriah, la première thérapie T-CAR approuvée au Canada pour les LLA à cellules B en rechute ou réfractaires chez l’enfant et le jeune adulte et les lymphomes diffus à grandes cellules B en rechute ou réfractaires chez l’adulte. Pour en savoir plus, cliquez ici.
Janvier 2019 : Santé Canada approuve le premier essai clinique sur les cellules T-CAR fabriquées au Canada.
Dans les deux ans qui ont suivi le lancement du projet dynamisant de BioCanRx sur le renforcement des capacités en matière de thérapies à base de cellules T-CAR au Canada, l’équipe composée des docteurs Natasha Kekre, Rob Holt, John Bell et John Webb a reçu l’approbation de Santé Canada pour les immunothérapies contre le cancer administrées au Canada : CLIC-1901 pour le traitement des patients atteints de tumeurs hématologiques positives CD19 en rechute ou réfractaires.
Janvier 2019 : L’INESSS recommande que le Québec fournisse Kymriah aux enfants et jeunes adultes souffrant de LLA diffuse à grandes cellules B et aux patients souffrant d’un lymphome à cellules B en rechute ou réfractaire. Pour en savoir plus, cliquez ici et ici.
Janvier 2019 : L’ACMTS recommande que les gouvernements provinciaux fournissent Kymriah aux enfants souffrant de LLA à cellules B en rechute ou réfractaire et aux adultes souffrant d’un lymphome diffus à grandes cellules B en rechute ou réfractaire. Pour en savoir plus, cliquez ici.
Février 2019 : Gilead reçoit l’approbation au Canada pour l’utilisation de la thérapie T CAR Yescarta chez les adultes souffrant d’un lymphome à grandes cellules B en rechute ou réfractaire après deux cycles ou plus de thérapie systémique. Pour en savoir plus, cliquez ici.
Mai 2019 : L’essai clinique CLIC-1901 est financé par BioCanRx.
Le Dr Natasha Kekre dirige l’essai clinique sur les immunothérapies dirigées au Canada contre le cancer (CLIC-1901) pour le traitement des patients souffrant de tumeurs hématologiques positives CD19 en rechute ou réfractaires. Cet essai utilise des lymphocytes T modifiés par récepteurs d’antigènes chimériques comme nouvel outil pour traiter les patients qui ont eu de mauvaises réponses à d’autres traitements. Les cellules T-CAR sont fabriquées en isolant un échantillon des lymphocytes T d’un patient à partir de son sang, en modifiant et en activant génétiquement les cellules en laboratoire, puis en les réadministrant au même patient, ce qui permet de cibler les cellules immunitaires d’un patient contre sa tumeur. Il s’agit du premier essai clinique sur des cellules T-CAR fabriquées au Canada.
Juillet 2019 : BioCanRx sollicite 1,8 M$ pour accroître la capacité de la thérapie T-CAR au Canada.
Le programme T-CAR de BioCanRx utilise des installations de fabrication de cellules T-CAR fermées et automatisées pour tirer pleinement parti des avantages de l’automatisation. Dans le cadre de son programme d’application des connaissances sur les cellules T-CAR proposé au cycle 2, BioCanRx s’est engagé à investir plus de 1,8 M$ dans des activités d’application des connaissances afin de permettre à différentes installations du Canada de fabriquer leurs propres cellules T-CAR dans leurs installations fermées et automatisées. En mettant en place ce réseau de fabrication « au point de service », nous faciliterons l’administration de ces thérapies vitales à des emplacements situés plus près du lieu de traitement des patients tout en soutenant le développement de nouvelles thérapies T-CAR qui pourraient être utilisées pour traiter d’autres cancers. En collaboration avec les organismes de réglementation et au cours des quatre prochaines années, BioCanRx s’est engagé à mettre à l’échelle un total de quatre centres de fabrication au point de service au Canada qui fabriqueront des produits T-CAR pour les utiliser dans des essais cliniques. Grâce à son dévouement au perfectionnement de la technologie et à l’accès à la fabrication, BioCanRx effectue des investissements ciblés dans le but de rendre cette nouvelle approche thérapeutique plus largement accessible au plus grand nombre de patients possible.
Décembre 2019 : Lancement du premier essai clinique sur la thérapie à base de cellules T-CAR fabriquées au Canada.
Le programme de recherche sur le récepteur d’antigène chimérique T (T-CAR) de BioCanRx a lancé le premier essai clinique canadien sur la thérapie T-CAR à l’Hôpital d’Ottawa, dirigé par la Dre Natasha Kekre, et à l’Agence du cancer de la C.-B., en partenariat avec l’Hôpital général de Vancouver, dirigé par le Dr Kevin Hay. L’essai canadien sur les immunothérapies contre le cancer (CLIC 01) est conçu pour les patients âgés de 18 à 75 ans, atteints de leucémie lymphoblastique aiguë (LLA) et de lymphome non hodgkinien qui ne répondent pas aux autres thérapies. C’est le premier essai qui utilise des cellules T-CAR fabriquées au Canada et, s’il est couronné de succès, il pourrait déboucher sur des thérapies T-CAR plus efficaces qui ciblent davantage de types de cancer, et un plus grand nombre d’innovations de recherche pourraient être offertes aux patients canadiens grâce au modèle de fabrication au point de service. L’essai clinique est financé par BioCanRx et est également soutenu par la Fondation du cancer de la C. B., la Fondation de l’Hôpital d’Ottawa et l’Institut ontarien de recherche sur le cancer.
« La thérapie T-CAR change la donne pour les personnes atteintes de certains types de cancer du sang, mais nous avons besoin de plus de recherche pour la rendre encore efficace. Avec ce premier essai, notre objectif est de renforcer l’expertise et la capacité d’innovation du Canada dans le domaine des thérapies T-CAR. Nous espérons que cela conduira à des thérapies T-CAR plus efficaces qui peuvent être utilisées pour plus de types de cancer, ainsi qu’à des approches innovantes pour fournir la thérapie T-CAR dans le réseau de santé canadien. » – Dre Natasha Kekre, chercheuse principale de l’essai CLIC-1901, hématologue et scientifique associée à l’Hôpital d’Ottawa et professeur adjoint à l’Université d’Ottawa.
Avril 2020 : Le deuxième cycle de financement de BioCanRx est approuvé par l’entremise du programme fédéral des Réseaux de centres d’excellence.
Dans cette nouvelle phase, BioCanRx cherche à étendre la portée de son programme des thérapies à base de cellules T-CAR fabriquées au Canada, à la fois en augmentant le nombre d’installations de fabrication et le nombre de types de cellules T-CAR. L’important pipeline de recherches cliniques à l’étude dans le monde entier démontre l’avancement continu des programmes T CAR, tant pour les cancers du sang que pour les tumeurs solides. L’importance d’ajouter les essais réussis sur les cellules T-CAR à notre arsenal de lutte contre le cancer est évidente. Toutefois, les complexités du processus de fabrication entravent le déploiement à grande échelle de ces thérapies. C’est la raison pour laquelle de nombreuses entreprises biotechnologiques et pharmaceutiques investissent dans l’automatisation pour faciliter le processus de fabrication et permettre une fabrication plus robuste, moins complexe, fermée et automatisée des cellules T CAR.
Avril 2020 – BioCanRx s’associe à l’Institut ontarien de recherche sur le cancer et à d’autres groupes pour financer et soutenir deux nouveaux projets d’impact clinique, social et économique utilisant des données réelles.
Le Dr Kelvin Chan de l’Institut de recherche Sunnybrook, est le chercheur principal du projet intitulé : Évaluer les résultats cliniques et économiques concrets des technologies innovantes et émergentes en oncologie : les biosimilaires et les cellules T-CAR.
Le Dr Chan et ses collègues étudient les technologies de la santé afin d’évaluer les résultats concrets pour la santé et l’impact économique des thérapies des cellules T-CAR en Ontario. L’équipe vise à déterminer le niveau réel d’adoption de ces thérapies, leur impact budgétaire, leur efficacité, leur sécurité et leur rentabilité afin de faciliter la planification du réseau, l’allocation des ressources et l’optimisation des soins aux patients.
La Dre Kednapa Thavorn, de l’Institut de recherche de l’Hôpital d’Ottawa, est la chercheuse principale du projet intitulé : Utilisation des données du monde réel et d’une évaluation économique itérative pour hiérarchiser l’affectation des ressources pour les soins et la recherche chez les patients adultes atteints de leucémie lymphoblastique aiguë (LLA) à lymphocytes B récurrente et réfractaire.
Afin de mieux comprendre les facteurs contribuant au coût des thérapies T CAR, les avantages cliniques potentiels du traitement et ce que le réseau de santé peut se permettre, la Dre Thavorn et son équipe appliqueront un cadre d’évaluation économique continue à la thérapie à base de cellules T CAR pour une utilisation chez les adultes souffrant d’une LLA à cellules B en rechute ou réfractaire. Le processus adoptera une approche multipartite incluant les patients, les cliniciens, les chercheurs et les payeurs de soins de santé. Les résultats de l’étude contribueront à faciliter l’établissement d’un coût réaliste pour la thérapie des cellules T CAR et aideront les payeurs publics à fixer le prix de la thérapie des cellules T CAR en fonction du bénéfice supplémentaire obtenu et des autres coûts associés au traitement.
Juillet 2020 : BioCanRx finance un projet de recherche devant déterminer quels sont les patients qui répondront positivement à la thérapie T-CAR en réalisant une analyse des données individuelles.
L’un des principaux résultats de l’examen systématique des essais sur les cellules T CAR (financé par BioCanRx) qui est réalisé par les docteurs Manoj Lalu et Dean Fergusson, a démontré que la thérapie peut être extrêmement efficace chez certaines personnes mais non chez d’autres. Les raisons de cette écart demeurent incertaines, mais de nouvelles preuves suggèrent que des caractéristiques précises concernant les personnes (par exemple le sexe biologique ou l’âge), l’état de la maladie ou la thérapie elle-même (la dose, par exemple) peuvent entraîner des écarts d’efficacité entre les patients. Dans ce projet d’impact clinique, social et économique récemment financé, le Dr Dean Fergusson (IRSO) et son équipe utiliseront les données individuelles des patients provenant des essais cliniques T CAR publiés pour évaluer l’impact de ces caractéristiques sur les taux de réponse. Le projet fournira également un examen actualisé de tous les essais de cellules T CAR chez les patients atteints de cancer du sang et de tumeurs solides. Les résultats de cette analyse aideront les cliniciens et les décideurs à optimiser la thérapie T CAR pour les patients et contribueront à éclairer la conception des futurs essais cliniques et des interventions qui pourraient démontrer des résultats plus sûrs et une meilleure efficacité.
Juillet 2020 : La FDA des États-Unis approuve Tecartus de Kite (brexucabtagene autoleucel, anciennement le KTE-X19), le premier et seul traitement T-CAR pour les adultes ayant un lymphome à cellules du manteau en rechute ou réfractaire.
Septembre 2020 : BioCanRx annonce le financement du soutien de prochaine génération pour le développement et la fabrication de thérapies T-CAR.
En septembre 2020, BioCanRx a annoncé que des fonds de 900 000 $ seraient affectés à deux projets visant à développer la prochaine génération de thérapies T CAR. Les projets, dirigés par les docteurs Kevin Hay (Agence du cancer de la C.-B.) et Scott McComb (uOttawa/CNRC) sont intitulés : Essai clinique multicentrique dynamisant de phase I/II sur une nouvelle thérapie des cellules T à récepteurs d’antigènes chimériques (T CAR) spécifiques dérivés de camélidés CD 22 à domaine unique et Études dynamisantes d’essai clinique sur la thérapie par récepteurs d’antigènes chimériques à cibles multiples pour le traitement des malignités touchant les lymphocytes B, respectivement.
En outre, BioCanRx a annoncé des investissements importants et ciblés pour la fabrication de cellules au point de service et pour la biofabrication de virus, ces investissements ayant été initialement confirmés en juillet 2019. Au total, ces investissements de près de 3,4 M$ visent à faciliter l’utilisation de biothérapies de pointe en augmentant la capacité de biofabrication au Canada, au profit des patients canadiens atteints de cancer.
Septembre 2021
Les docteurs Kevin Hay et Natasha Kekre et leurs collègues ont reçu 1,67 million de dollars pour un essai clinique du CLIC-22, une thérapie à base de cellules T-CAR conçue pour le traitement du lymphome non hodgkinien à cellules B positives CD22 récurrentes et réfractaires. Cette thérapie a été développée avec BioCanRx.
En savoir plus
Résumé du projet: projets dynamisants
Avril 2022
BioCanRx a attribué au Dr Douglas Mahoney la somme de 125 000 $ à l’appui du développement d’une nouvelle thérapie à base de cellules T-CAR dans le cadre d’une étude habilitante intitulée « Thérapie à base de cellules T-CAR personnalisée pour un patient atteint d’un sarcome rare »