L’impact de BioCanRx
Améliorer l'accès
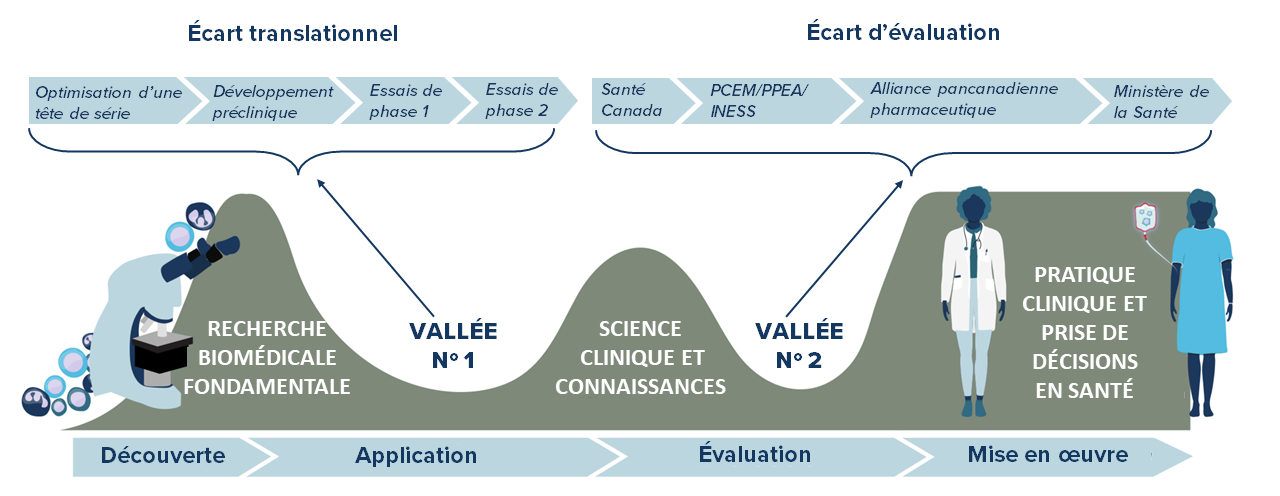
Les produits et plateformes biothérapeutiques émergents transforment le domaine de l’immunothérapie du cancer. Ces innovations offrent un nouvel espoir en matière de soins contre le cancer, mais elles peuvent devoir faire face à de nombreux obstacles sociaux, juridiques, éthiques, économiques ou liés au système de santé à mesure qu’elles progressent dans le pipeline translationnel de la recherche préclinique aux essais cliniques et au-delà.
Afin d’aider à élaborer de possibles solutions à ces défis, BioCanRx a créé le Programme d’analyse de l’impact clinique, social et économique (ICSE). Le programme vise à faire en sorte que notre pipeline de projets de recherche et projets cliniques financés recueille « les bonnes données, de la bonne façon, au bon moment ». Ces projets concernent ce qui est nécessaire pour mettre au point avec succès de nouvelles thérapies. Le programme d’ICSE permet l’application et l’adoption réussies d’innovations en immunothérapie du cancer :
- En appuyant la science translationnelle pour accroître l’efficience de la recherche translationnelle par la compréhension des principes scientifiques et opérationnels qui sous-tendent chaque étape du processus translationnel;
- En évaluant et en positionnant les nouvelles immunothérapies en développement en vue de leur adoption dans le système de santé du Canada;
- En examinant les défis liés à la politique de réglementation du Canada qui influent sur le cheminement des traitements curatifs entre le laboratoire et le chevet du patient.
Appuyer la science translationnelle
L’entrée de nouvelles thérapies dans le pipeline allant du laboratoire au chevet du patient peut comporter des défis. Ceux-ci sont habituellement liés à des défauts dans la conception et la méthodologie des projets de recherche. Une conception et une méthodologie expérimentales robustes et impartiales pour l’analyse et l’interprétation d’études d’application clinique sont essentielles pour assurer la rigueur et la reproductibilité avant de passer à l’étape d’application suivante, et finalement pour faire en sorte que les thérapies prometteuses se rendent aux patients canadiens. Grâce à son programme d’ICSE, BioCanRx appuie les pratiques exemplaires dans ce domaine.
Des évaluations de travaux de recherche préclinique ont constamment établi que des éléments clés de la méthodologie de recherche (p. ex. insu et randomisation) sont absents des ouvrages publiés, ce qui peut mener à l’irreproductibilité des constatations, et même à des obstacles quant à la mise au point de nouvelles immunothérapies. Pour aider à surmonter ce problème, BioCanRx a appuyé les Drs Dean Fergusson et Manoj Lalu (IRHO) en finançant un projet d’ICSE visant l’élaboration d’un atelier sur la conception expérimentale préclinique et la production de rapports à l’intention de chercheurs financés qui entreprennent des recherches précliniques, atelier qui continuera d’être offert.
Évaluer et positionner les nouvelles biothérapies en développement en vue de leur adoption future dans le système de santé canadien
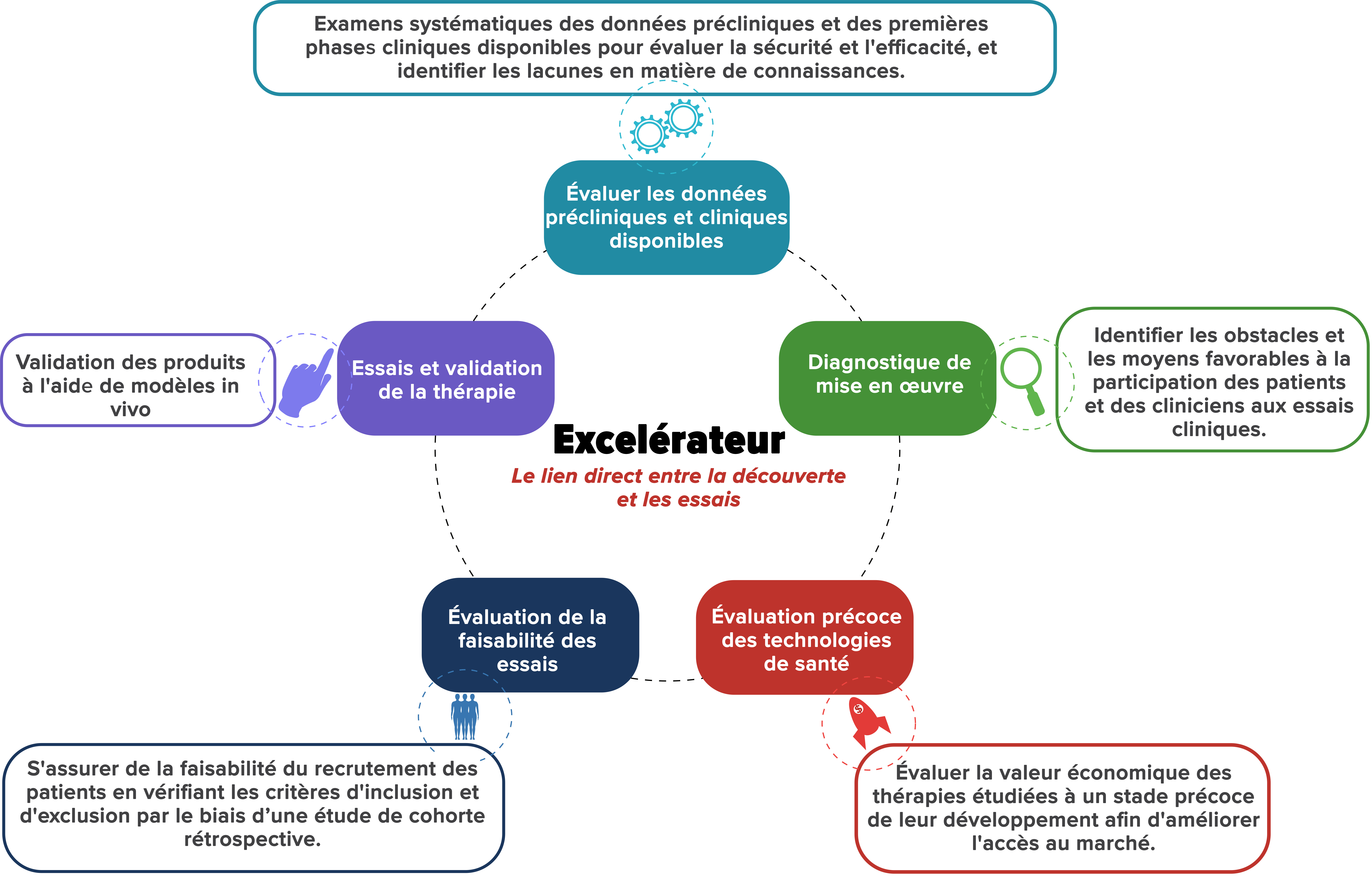
Un exemple de projet d’ICSE est Getting better Outcomes with Chimeric Antigen Receptor T-cell therapy (GO–CART) (l’obtention de meilleurs résultats avec la thérapie à récepteurs d’antigènes chimériques (GO–CART)). Il s’agit d’un projet d’application intégré des connaissances qui met en évidence un outil essentiel pour élaborer des protocoles d’essai clinique pour de nouvelles thérapies comportant de multiples intervenants (patients et oncologues) et pour tirer parti d’une base exhaustive de données probantes. L’équipe GO CART a élaboré des protocoles pour différentes composantes de l’étude et un protocole d’essai; ceux-ci ont été conçus avec des patients partenaires afin d’assurer la pertinence pour la population cible de patients. Cette façon de concevoir les protocoles d’essai clinique, qui intègre l’évaluation précoce des technologies de la santé (EPTS), fait partie de la plateforme du programme de cellules T-CAR de BioCanRx.
Avoir une longueur d’avance grâce à l’évaluation précoce des technologies de la santé (EPTS)
Le parcours pour mettre une nouvelle thérapie sur le marché dépend de deux processus séquentiels : obtenir l’autorisation de mise sur le marché de l’organisme de réglementation (Santé Canada) et le remboursement d’un payeur (un ministère de la santé provincial). La réalisation en séquence de ces deux évaluations liées mais différentes prend du temps. Afin de permettre un accès plus opportun aux médicaments, Santé Canada a élaboré une initiative qui permettrait l’alignement de ces processus avec ceux des organisations d’évaluation des technologies de la santé comme l’Agence canadienne des médicaments et des technologies de la santé (ACMTS) et l’Institut national d’excellence en santé et en services sociaux (INESS – Québec). Ces processus se déroulent à des étapes plus avancées d’un cycle de développement des produits (phase III).
L’EPTS désigne l’évaluation précoce des profils de sécurité, d’efficacité et de coût-efficacité de nouvelles technologies médicales selon des données probantes tirées principalement des résultats de recherches cliniques de phase préliminaire. L’intégration de l’EPTS aux premiers stades de la recherche clinique est une étape importante pour informer différents intervenants de la valeur potentielle d’une nouvelle thérapie. Cette évaluation permet d’examiner le ratio coût-efficacité et la faisabilité d’une innovation dès le départ, comme le démontre le projet GO CART pour la thérapie à base de cellules T CAR.
Le besoin persistant d’évaluer la valeur « réelle » de traitements contre le cancer prévaut de plus en plus dans le contexte actuel d’explosion des coûts des soins contre le cancer. L’avènement de thérapies biologiques hautement personnalisées et extrêmement complexes exige une évaluation économique exhaustive pour aider les décideurs du milieu des soins de santé et les organismes de financement à allouer des ressources limitées. BioCanRx soutient la recherche qui vise à recueillir des données aux premiers stades de l’évaluation clinique pour informer les intervenants, y compris les décideurs politiques, au sujet de la valeur potentielle de nouveaux produits médicaux en développement.
Les outils d’EPTS sont utilisés dans des essais cliniques de phase 1 ou d’autres projets financés dans le cadre du portefeuille de thérapies de BioCanRx. Un autre exemple est Developing System-Level Policy Model for Regenerative Medicine and Cell Therapy in Oncology (Élaboration d’un modèle de politique à l’échelle systémique pour la médecine régénératrice et la thérapie cellulaire en oncologie – Drs Wong, Université de Waterloo, et Chan, Centre des sciences de la santé Sunnybrook). Il s’agissait d’un projet d’EPTS crucial pour documenter davantage le parcours vers la mise en œuvre de la thérapie à base de cellules T CAR au Canada. Le projet réunissait des représentants d’organismes de réglementation et de payeurs pour qu’ils étudient d’importantes questions stratégiques liées à l’opportunité et à l’utilisation des thérapies à base de cellules T CAR auprès de patients de l’Ontario. Les résultats de ces travaux ont été partagés avec les utilisateurs ultimes des connaissances : l’ACMTS, l’organisme canadien chargé de l’ETS et Santé Ontario.
Recueillir des données probantes du monde réel pour étayer la prise de décisions
Un autre exemple de projet d’ICSE est Évaluer les résultats cliniques et économiques concrets des technologies innovantes et émergentes en oncologie : les biosimilaires et les cellules T-CAR. Le Dr Kelvin Chan a examiné deux genres de thérapies anticancéreuses – l’utilisation d’un biosimilaire, le bevacizumab, pour traiter le cancer colorectal avancé, et la thérapie à base de cellules T CAR pour traiter la leucémie chez des enfants et le lymphome chez des adultes – pour voir comment ils se comportent dans le monde réel. Comment est-il possible d’obtenir ces données probantes du monde réel? Au Canada, c’est plus facile qu’à bien d’autres endroits, en grande partie parce que notre système de santé public fait en sorte qu’il existe de grands ensembles de données sur les patients et de données administratives.
Au niveau des patients, le Dr Chan a suivi des patients à partir de leur admission initiale pour confirmer des choses comme les taux de survie et les effets secondaires. Il a cherché des résultats comme le retour à l’hôpital après le traitement et les patients se rendant à l’urgence. Il a également étudié les caractéristiques de base des patients pour en apprendre plus sur ceux qui ont reçu ces traitements et déterminer si des facteurs comme les troubles comorbides influent sur les résultats. Au niveau du système, le Dr Chan examine l’utilisation des ressources, soit les coûts, et les facteurs qui entraînent leur augmentation, ou qui aident à les réduire. Un traitement réussi, par exemple, peut faire baisser les coûts totaux parce que les traitements ultérieurs ne sont pas nécessaires. Les traitements qui échouent, et ceux qui ont des effets secondaires importants, peuvent faire augmenter les coûts.
Travailler avec les décideurs politiques pour rationaliser la réglementation
Un système de réglementation efficace est essentiel à l’avancement de la recherche transactionnelle et à la mise en place d’un écosystème des sciences de la vie dynamique. Parfois, un changement de réglementation subtil donne des résultats imprévus, comme ce fut le cas avec l’inclusion d’« une particule de type virus ou une particule sous-virale » dans la définition de « micro-organisme » du Règlement sur les renseignements concernant les substances nouvelles (organismes) (RRSN(organismes)), qui a eu un impact sur les thérapies cellulaires et géniques et leur commercialisation.
L’exigence d’un examen indépendant de 120 jours d’Environnement et Changement climatique Canada (ECCC) avant un examen de Santé Canada sur les préoccupations en matière de qualité et d’environnement a imposé un fardeau supplémentaire aux promoteurs soumettant des demandes d’essais cliniques (DEC) ou des présentations de drogues nouvelles (PDN). La première recommandation de cet atelier et examen des politiques a été adoptée par le Gouvernement du Canada, ce qui a mené à la recommandation, dans le Budget 2021, d’intégrer l’évaluation des risques environnementaux aux étapes de soumission de Santé Canada, créant un guichet unique pour soumettre des données. Ces travaux de « données probantes à politique à pratique » financés par BioCanRx et dirigés par la Dre Tania Bubela (USF) offrent un excellent exemple de la rationalisation de la réglementation pour réaliser de plus grands gains d’efficacité!

