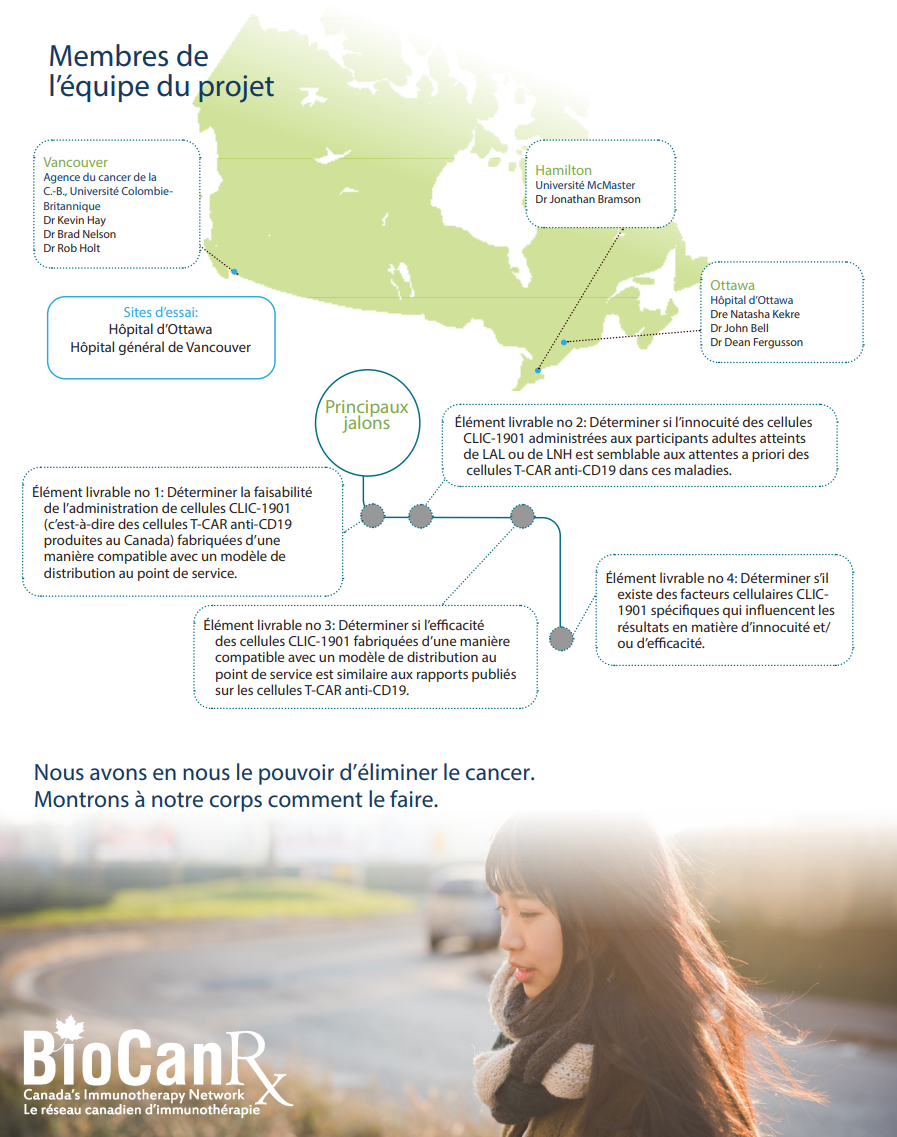
Immunothérapies du cancer dirigées par le Canada : CLIC-1901 pour le traitement des patients atteints de tumeurs malignes hématologiques positives à la CD19 en rechute ou réfractaires
Du 15 mai 2019 au 31 mars 2024
Points saillants

- Les cellules T-CAR sont fabriquées en isolant un échantillon des lymphocytes T provenant du sang d’un patient, en modifiant génétiquement et en activant les cellules en laboratoire, puis en les réadministrant au même patient, ce qui permet aux cellules immunitaires du patient d’être ciblées pour combattre la tumeur.
- La thérapie T-CAR est très personnalisée, de sorte qu’une infrastructure et une expertise importantes sont nécessaires pour produire et administrer ce traitement en toute sécurité et avec succès.
- Il s’agit du premier essai clinique de cellules T-CAR fabriquées au Canada.
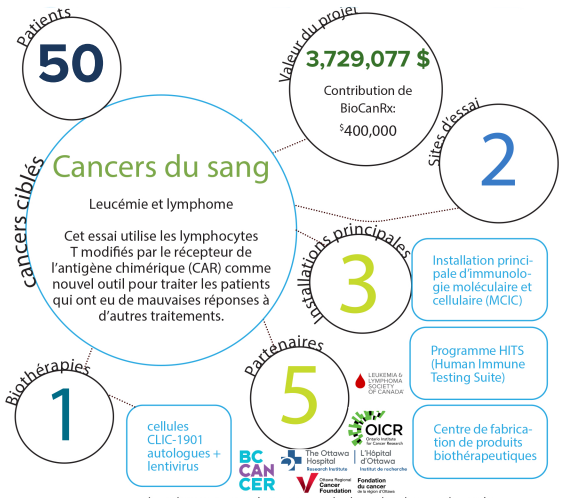
À propos du projet
Les patients atteints de certaines formes de cancer du sang qui ne répondent pas aux traitements standard ont des chances de survie particulièrement faibles. Les lymphocytes T modifiés par le récepteur de l’antigène chimérique (T-CAR) sont un nouvel outil puissant pour traiter ces patients.
Les cellules T-CAR sont fabriquées en isolant un échantillon des lymphocytes T d’un patient (un type de globules blancs) de son sang, en modifiant génétiquement et en activant les cellules en laboratoire, puis en les réadministrant au même patient, ce qui permet aux cellules immunitaires du patient d’être ciblées contre la tumeur.
À ce jour, les résultats de l’utilisation des cellules T-CAR dans certaines leucémies et certains lymphomes ont été phénoménaux dans certains cas et ont produit des réponses durables, ce qui suggère que les patients qui répondent bien à la thérapie sont guéris de leur malignité sous-jacente. Parce que la thérapie T-CAR est très personnalisée (elle nécessite la modification génétique des propres cellules du patient), l’infrastructure et l’expertise requises sont considérables pour fabriquer et administrer ce traitement en toute sécurité et avec succès.
BioCanRx a joué un rôle essentiel dans ce domaine en fournissant les fonds requis pour le développement des procédés et la fabrication des matériaux nécessaires à la production de cellules T CAR, ainsi que pour la rédaction de la demande d’essai clinique que Santé Canada doit approuver aux fins d’un essai clinique. Notre équipe est maintenant prête à fournir cette thérapie et cherche à obtenir du financement de BioCanRx pour soutenir le déploiement de cet essai clinique. Ce financement servirait à couvrir les coûts de fabrication et des soins cliniques des patients dans le cadre du premier essai clinique de cellules T-CAR fabriquées au Canada.