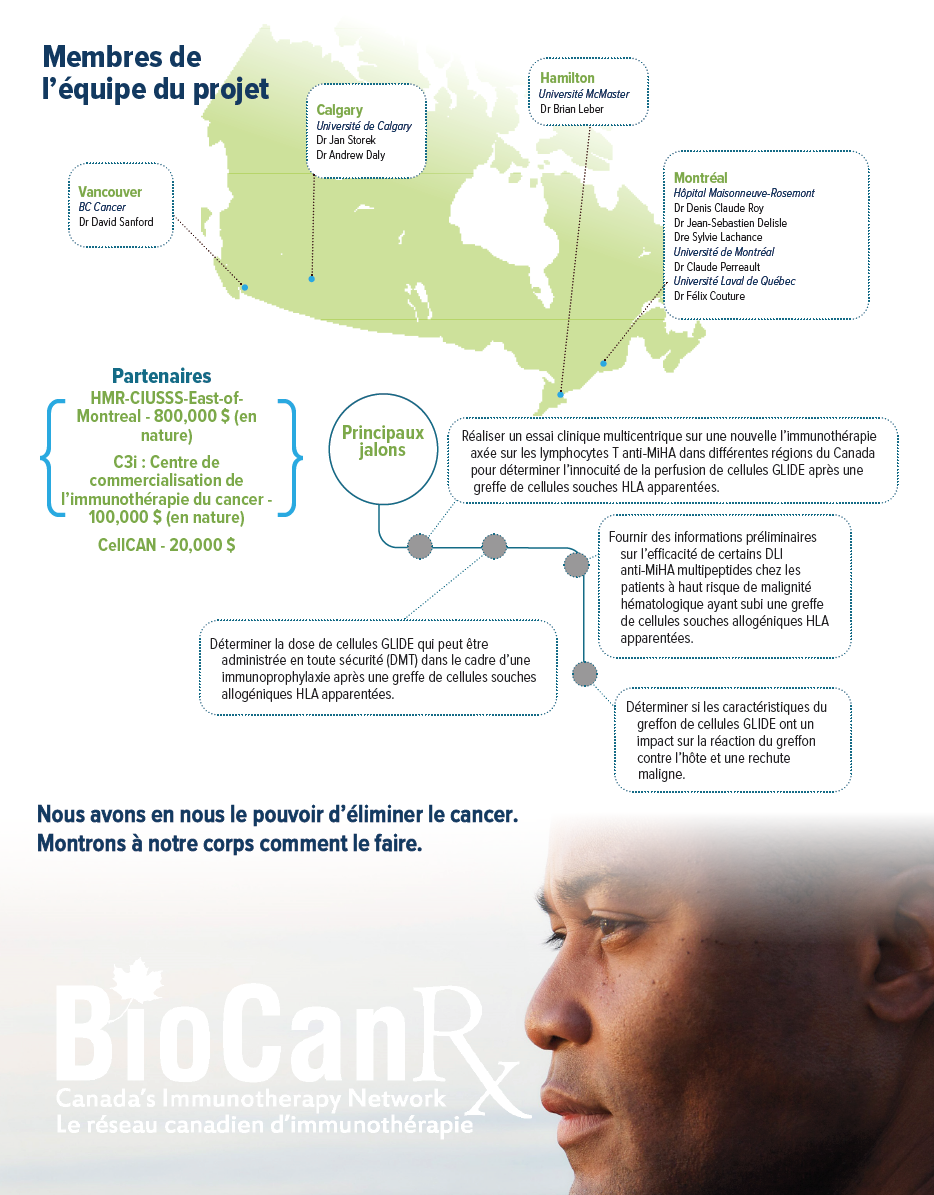
Résumé du projet: essai clinique
Essai clinique de phase I multicentrique, interventionnel, ouvert et non randomisé d’augmentation de la dose sur l’immunothérapie ciblant l’antigène multipeptidique d’histocompatibilité mineure pour la prévention des rechutes chez les patients présentant une malignité à haut risque et pouvant bénéficier d’une greffe de cellules souches allogéniques apparentées et compatibles
1er juillet 2020 – 31er mars 2024
Points saillants

- Un essai clinique constituant une « première chez l’homme » dans les cas de rechute a déjà montré des signes d’activité sans toxicité grave. Cet essai facilitera la mise en oeuvre et augmentera la population cible de patients.
- De nouveaux MiHA bien définis, qui sont i) exprimés principalement ou uniquement sur les cellules hématopoïétiques et ii) qui sont surexprimés sur les cellules néoplasiques, sont utilisés pour générer une perfusion de lymphocytes donneurs anti-MiHa avec une approche de fabrication qui évite l’épuisement des lymphocytes T et qui est administrée 60 jours après la greffe de cellules souches allogéniques.
- Des essais complémentaires avec la nouvelle PI ont également été conçus et mis en oeuvre sous la supervision du Centre de commercialisation de l’immunothérapie du cancer (C3i).

À propos du projet
Les rémissions à long terme des malignités hématologiques après une greffe de cellules souches allogéniques (ASCT) reposent en grande partie sur la réaction du greffon contre la leucémie. Dans un contexte de compatibilité totale avec les HLA, la réaction du greffon contre la leucémie est médiée par les réponses immunitaires des lymphocytes T contre les antigènes d’histocompatibilité mineurs de l’hôte (MiHAs) trouvés à la surface des cellules malignes. De 16 à 51 % des patients atteints de LMA connaissent une récidive de leur maladie dans les 2 ans suivant l’AHCT. Chez les patients présentant une un haut risque de malignité hématologique, la réaction du greffon contre la leucémie semble plus limité et on sait que l’évolution de la maladie est supérieure à 50 %, ce qui remet en cause les avantages de cette immunothérapie. Les patients souffrant de rechute de leucémie aiguë ou du syndrome myélodysplasique après l’AHCT peuvent être traités avec des perfusions de lymphocytes donneurs d’origine (DLI), mais seulement de 10 à 30 % d’entre elles permettent d’obtenir une rémission.
La capacité à cibler les MiHAs exprimés préférentiellement sur les cellules leucémiques est une stratégie prometteuse pour prévenir les rechutes après une ASCT. Dans cette étude, les chercheurs utiliseront une nouvelle stratégie immunothérapeutique en sélectionnant 98 MiHAs exprimées préférentiellement sur des cellules de cancers hématologiques par rapport à d’autres tissus afin de générer une lignée de lymphocytes T anti-MiHA (GLIDE) tout en minimisant le risque de réaction du greffon contre l’hôte.
Dix patients qui ont rechuté après une ASCT ont déjà été traités avec une ou deux perfusions de lymphocytes T stimulées par un seul (n=9) ou plusieurs (n=1) peptides anti-MiHA dans une étude de phase I multicentrique. Ce traitement a montré des signes d’activité sans toxicité. À la suite de cette validation de principe, les chercheurs prévoient générer un DLI ciblant plusieurs peptides MiHA qui sera administré simultanément 60 jours après l’ASCT chez les patients atteints de malignités hématologiques à haut risque pour augmenter la réaction du greffon contre la leucémie et améliorer le pronostic à long terme du patient.
Cette étude porte sur les domaines prioritaires de BioCanRx : elle étudie une nouvelle stratégie immunothérapeutique pour les cancers du sang à haut risque; elle utilise des DLI anti-MiHA biologiquement pertinents et ciblant le cancer; elle est mise au point grâce à des approches génomiques et immunologiques de pointe; elle intègre la stratégie d’expansion multiplex ex vivo; elle évalue son activité (ETS) dans un cadre d’essai clinique. Mais surtout, elle rassemble les efforts des grands centres du pays.